Filósofos Gregos


Os primeiros que imaginaram a existência dos átomos foram os filósofos gregos Leucipo e Demócrito em, aproximadamente, 450 a.C. Nesse modelo, tudo seria formado por minúsculas partículas indivisíveis. Daí a origem do nome “átomo”, que vem do grego a (não) e tomo (partes). Entretanto, essas ideias não puderam ser comprovadas na época, constituindo-se apenas como hipóteses.
Átomos Maciços - Matéria Contínua
Alguns cientistas passaram a realizar testes experimentais cada vez mais precisos graças aos avanços tecnológicos. Com isso, não só se descobriu que tudo era realmente formado por minúsculas partículas, mas também foi possível entender cada vez mais sobre a estrutura atômica.


Em 1803, Dalton retomou as ideias de Leucipo e Demócrito e propôs que a matéria é formada por átomos, que são partículas minúsculas, maciças, esféricas e indivisíveis. Esse modelo fazia uma analogia à estrutura de uma bola de bilhar. Todos os átomos seriam assim, diferenciando-se somente pela massa, tamanho e propriedades para formar elementos químicos diferentes.

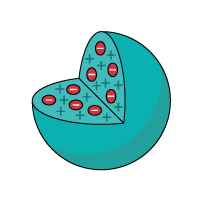
Por meio de um experimento com uma ampola de Crookes (um tubo de vidro fechado com um eletrodo positivo e um negativo onde se colocavam gases em pressões baixíssimas e submetidos a altas voltagens), J. J. Thomson descobriu que existiam partículas negativas que compunham a matéria. Isso significava que o modelo de Dalton estava errado porque o átomo seria divisível, tendo em vista que ele teria partículas ainda menores negativas chamadas de elétrons. Visto que o átomo é neutro, cargas positivas também deveriam existir. Assim, para J. J. Thomson em 1898, o átomo é constituído de uma partícula esférica de carga positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula. O modelo atômico de Thomson parecia com um pudim ou bolo de passas.
Átomos nucleados - Matéria Descontínua

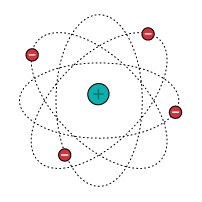
Em 1911, o físico neozelandês Ernest Rutherford realizou um experimento em que ele bombardeou uma finíssima lâmina de ouro com partículas alfa (α) emitidas por uma amostra de polônio (material radioativo) que ficava dentro de um bloco de chumbo com um pequeno orifício pelo qual as partículas passavam. Baseado nos resultados desse experimento, Rutherford percebeu que, na verdade, o átomo não seria maciço como propôs os modelos de Dalton e Thomson. Para Rutherford o átomo é descontínuo e é formado por duas regiões: o núcleo e a eletrosfera. O núcleo é denso e tem carga positiva, ou seja, é constituído de prótons. A eletrosfera é uma grande região vazia onde os elétrons ficam girando ao redor do núcleo.

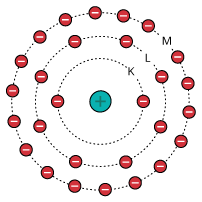
Em 1913, o cientista Niels Bohr (1885-1962) propôs um modelo que se baseou no de Rutherford, apenas o aprimorando. Entre seus principais postulados: Os elétrons movem-se em órbitas circulares, e cada órbita apresenta uma energia bem definida e constante (nível de energia) para cada elétron de um átomo. E tais camadas eletrônicas ou níveis de energia passaram a ser representadas pelas letras K, L, M, N, O, P e Q, respectivamente, no sentido da camada mais próxima ao núcleo para a mais externa.


No modelo de Sommerfeld, os níveis energéticos são compostos por subníveis de energia e os elétrons percorrem órbitas elípticas na eletrosfera, ao invés de circulares.


Surgimento do Modelo atômico atual (Orbital ou Quântico): Erwin Schrodinger, em 1926, lançou as bases da Mecânica Quântica Ondulatória, apresentando um novo modelo atômico que ainda é valido. Nele, os elétrons passam a ser partículas-onda, e há alguns princípios que mudam completamente a ideia de que os elétrons são “bolinhas” em movimento rápido, girando em torno do núcleo.
Princípios do modelo atômico atual:
- Princípio da dualidade.
- Princípio da incerteza.
- Princípio do orbital.
- Princípio da exclusão.
- Princípio da máxima multiplicidade.

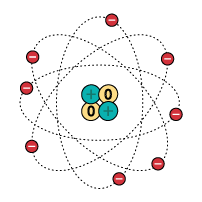
Em 1932, o cientista James Chadwick descobriu a terceira partícula subatômica, o nêutron. Dessa forma, o modelo de Rutherford passou a ter os nêutrons no núcleo junto aos prótons.